Medizinprodukte reichen von Alltagsprodukten wie Pflastern, Fieberthermometern und Blutdruckmessgeräten über Hüftprothesen bis hin zu komplexen Geräten wie Röntgen- und Magnetresonanz-Tomografie-Geräten. Sollen diese in der EU in Verkehr gebracht werden, müssen sie den europäischen Vorschriften entsprechen und mit der CE-Kennzeichnung versehen sein. Die rechtliche Grundlage hierfür bildet die Verordnung (EU) 2017/745 über Medizinprodukte (MDR – Medical Device Regulation).
Einen umfassenden Überblick über die zur CE-Kennzeichnung erforderlichen Schritte finden Sie in unserer Broschüre „10 Steps to CE Mark“.
Auf dieser Seite erhalten Sie Informationen über die Zertifizierungsdienstleistungen, die SGS mit ihren Benannten Stellen (Notified Bodies) SGS Fimko (CE 0598) und SGS Belgium (CE 1639) anbietet.

Konformitätsbewertung durch eine Benannte Stelle
Gehört ein Medizinprodukt einer höheren Risikoklasse als Klasse I an, muss die Konformität mit den Vorgaben der MDR von einer Benannten Stelle bewertet werden.
Abhängig von der Risikoklasse gibt es verschiedene Wege der Konformitätsbewertung.
Unsere Infografik veranschaulicht die möglichen Verfahren gemäß MDR-Artikel 52 und zeigt, worauf bei der Vorbereitung auf die Konformitätsbewertung zu achten ist.
Wir empfehlen den Weg über Anhang IX (Konformitätsbewertung auf der Grundlage eines Qualitätsmanagementsystems (QMS) und der Bewertung der technischen Dokumentation), da die MDR ein QMS mit Mindestanforderungen an Hersteller von Medizinprodukten vorschreibt.
Zertifizierungsverfahren mit SGS
Wenn Sie planen, Ihr Medizinprodukt mit Unterstützung einer Benannten Stelle zertifizieren zu lassen (entspricht Schritt 6 und 7 der oben genannten Broschüre „10 Steps to CE Mark“), wenden Sie sich gerne an uns. Sie erhalten die erforderlichen Antragsunterlagen sowie weiterführende Informationen zum Zertifizierungsverfahren, das mehrere Schritte (A bis G) umfasst – beginnend mit Ihrem Antrag.
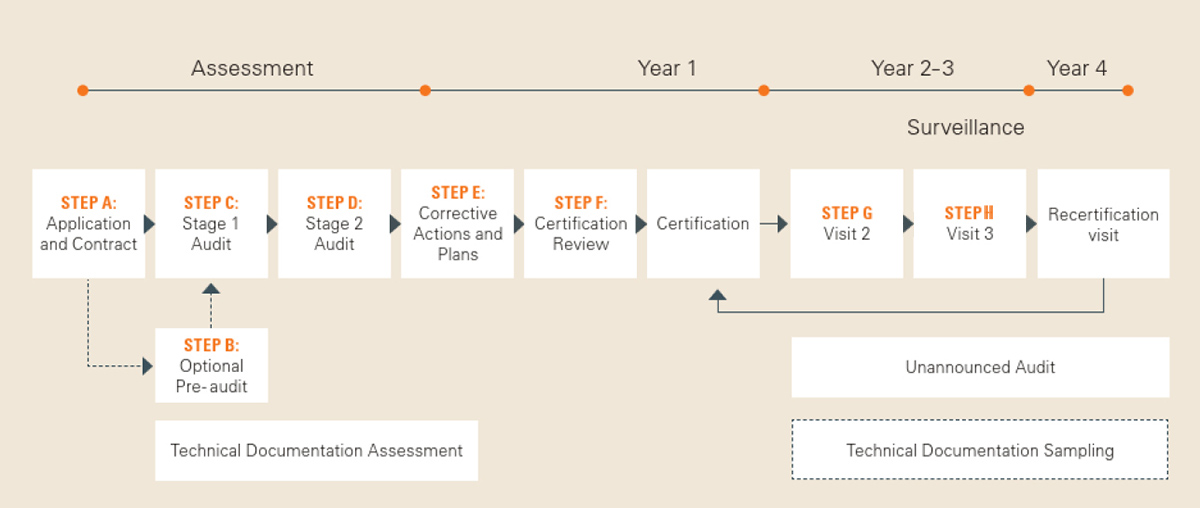
Unsere Broschüre „Your Certification Process Explained“ bietet Ihnen im Vorfeld eine detaillierte Erläuterung dieser Schritte.
Da sich Medizinprodukte und Hersteller stark unterscheiden, ist ohne Prüfung Ihres Antrags keine belastbare Einschätzung zu Durchlaufzeiten oder Kosten möglich. Einen ersten Überblick über die zu erwartenden Aufwände bietet Ihnen unsere MDR-Standardgebührenliste.
Weitere Informationen
Die MDR (EU) 2017/745 ist als Rechtsvorschrift nicht immer leicht zu interpretieren. Aus diesem Grund veröffentlicht die Medical Device Coordination Group (MDCG) eine Reihe von MDCG Guidance Documents.
Diese enthalten praxisnahe Empfehlungen zu verschiedenen Themen – von EUDAMED über Klassifizierungsfragen bis hin zur Interpretation von wesentlichen Änderungen. Zwar sind die MDCG-Dokumente rechtlich nicht bindend, sie werden jedoch von Benannten Stellen angewandt und sind als ergänzende Lektüre sehr zu empfehlen.
Downloads
- 10 Steps to CE Mark
Merkblatt zu den 10 Schritten, die für die CE-Kennzeichnung eines Medizinprodukts erforderlich sind (CE Certification) - Konformitätsbewertungsverfahren
Infografik zur Veranschaulichung der verschiedenen verfügbaren Konformitätsbewertungsverfahren (Conformity Assessment Routes) - Your Certification Process Explained
Medical Device Certification – dieses Dokument erläutert die Schritte des initialen Zertifizierungsprozesses und den Auditzyklus gemäß MDR - MDR – Client Technical Documentation Submission Checklist
Inhaltsverzeichnis und Struktur der einzureichenden technischen Dokumentation - MDR Standard Fees List
Kosten für den Zertifizierungsprozess
Ihre Ansprechpartner
Armin Hudetz
t: +49 89 78 74 75-133
E-Mail: Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!
Customer Service Team
t: +49 89 78 74 75-222
E-Mail: Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!




 SGS verfügt über mehrere Zertifizierungsstellen zu den Europäischen Richtlinien.
SGS verfügt über mehrere Zertifizierungsstellen zu den Europäischen Richtlinien. Benannte Stelle MED
Benannte Stelle MED